Ligação peptídica: unindo aminoácidos
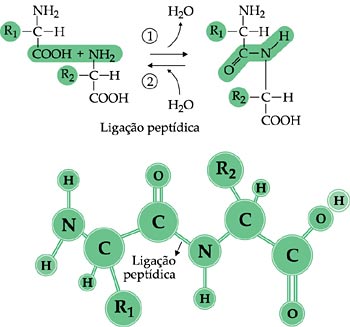 | Do mesmo modo que em um trem cada vagão está engatado ao seguinte, em uma proteína cada aminoácido está ligado a outro por uma ligação peptídica. Por meio dessa ligação, o grupo amina de um aminoácido une-se ao grupo carboxila do outro, havendo a liberação de uma molécula de água. Os dois aminoácidos unidos formam um dipeptídio. A ligação de um terceiro aminoácido ao dipeptídeo origina um tripeptídeo que então, contém duas ligações peptídicas. Se um quarto aminoácido se ligar aos três anteriores, teremos um tetrapeptídeo, com três ligações peptídicas. Com o aumento do número de aminoácidos na cadeia, forma-se um polipetídio, denominação utilizada até o número de 70 aminoácidos. A partir desse número considera-se que o composto formado é uma proteína. |
Aminoácidos essenciais e naturais
Todos os seres vivos produzem proteínas. No entanto, nem todos produzem os vinte tipos de aminoácidos necessários para a construção das proteínas. O homem, por exemplo, é capaz de sintetizar no fígado apenas onze dos vinte tipos de aminoácidos. Esses onze aminoácidos são considerados naturais para a nossa espécie. São eles:alanina, asparagina,cisteína, glicina, glutamina, histidina, prolina, tiroxina, ácido aspártico, ácido glutâmico.
Os outros nove tipos, os que não sintetizamos, são os essenciais e devem ser obtidos de quem os produz (plantas ou animais). São eles: arginina, fenilalanina, isoleucina, leucina, lisina, metionina, serina, treonina, triptofano e valina.
É preciso lembrar que um determinado aminoácido pode ser essencial para uma espécie e ser natural para outra.
Uma visão espacial da proteína
Uma molécula de proteína tem, a grosso modo, formato de um colar de contas. O fio fundamental da proteína, formado como uma seqüência de aminoácidos (cuja seqüência é determinada geneticamente), constitui a chamada estrutura primária da proteína.
Ocorre, porém, que o papel biológico da maioria das proteínas depende de uma forma espacial muito mais elaborada. Assim, o fio fundamental é capaz de se enrolar sobre si mesmo, resultando um filamento espiralado que conduz à estrutura secundária, mantida estável por ligações que surgem entre os aminoácidos.
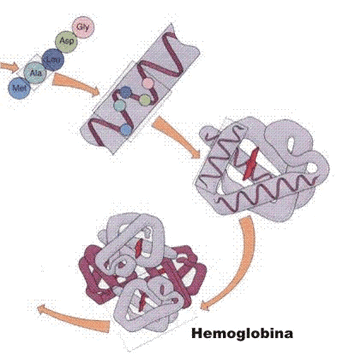
Novos dobramentos da espiral conduzem a uma nova forma, globosa, mantida estável graças a novas ligações que ocorrem entre os aminoácidos. Essa forma globosa representa a estrutura terciária.
Em certas proteínas , cadeias polipeptídicas em estruturas terciárias globosa unem-se, originando uma forma espacial muito complexa, determinante do papel bioquímico da proteína. Essa nova forma constitui a estrutura quaternária dessas proteínas.
A figura abaixo mostra as quatro estruturas da hemoglobina juntas. Q hemoglobina esta presente dentro os glóbulos vermelhos do sangue e seu papel biológico é ligar-se a moléculas de oxigênio, transportando-as a nossos tecidos.
Nenhum comentário:
Postar um comentário